多吃不胖的秘密,胆汁酸如何促进能量代谢?
胆汁酸(bile acids,BAs)一直以来被人们熟知的作用是食物脂肪的消化吸收和胆固醇代谢,最新的研究发现胆汁酸同样是一类重要的信号分子。胆汁酸激活丝裂原活化蛋白激酶途径,是G蛋白偶联受体(GPCR)TGR5配体,激活核激素受体,如法尼醇X受体α(FXR-α;NR1H4)。
FXR-α调控肠肝循环以及胆汁酸的生物合成,通过控制基因的表达,如小二聚体伴侣(SHP;NR0B2)抑制其它核受体的活性。FXR-α介导的SHP也发挥下调肝脏脂肪酸、甘油三酸酯生物合成以及被固醇调节原件结合蛋白1c介导的极低密度脂蛋白的产生。这表明除了控制胆汁酸稳态,胆汁酸可以作为常规的代谢整合者发挥功能。
这里我们展示在小鼠中胆汁酸能够增强褐色脂肪组织中的能量代谢,防止肥胖和胰岛素抵抗。这种新发现的胆汁酸代谢效应是严格依赖于环磷腺苷依赖甲状腺激素激活酶2型酶甲状腺素去碘酶(cyclic-AMP-dependent thyroid hormone activating enzyme type 2 iodothyronine deiodinase,D2)的诱导,因为在D2敲除小鼠中这种效应是不存在的。用胆汁酸处理棕色脂肪和人类骨骼肌细胞能提高D2活性和耗氧作用。这些效应不依赖于FXR-α,事实上是胆汁酸结合G蛋白偶联受体TGR5,提高cAMP来介导的。
啮齿动物和人类中,发挥生热作用的重要组织均特异性的受这个机制控制,因为共同表达D2和TGR5。因此胆汁酸BA-TGR5-cAMP-D2信号通路是一条微调能量平衡关键性机制,能够作为改善代谢控制的靶标。
1、胆汁酸安全高效控制体重
为了研究胆汁酸BAs的代谢作用,我们给小鼠高脂饮食(HFD)并添加0.5% w/w胆酸(cholic acid,CA)。长达47天内添加胆酸对小鼠完全没有毒副作用。没有毒副作用体现在饲喂胆酸并不影响小鼠采食、营养的吸收以及血清肝脏酶活(图1a)。
饲喂高脂饮食的小鼠相对对照组体重增加,补充胆酸后高脂饮食小鼠体重增加与正常饮食小鼠相似。正常饮食下补充胆酸对小鼠体重增加没有影响。体重增加的改变主要体现在脂肪的变化:饲喂高脂饮食的动物附睾白色脂肪组织(WAT),肠系膜WAT,以及肩胛区棕色脂肪(BAT)重量显著增加。
高脂饮食下BAT泛白,表明代谢活力的降低以及脂肪堆积的增加。另外,BAT周遭的WAT也出现增大。额外添加CA完全阻止了高脂饮食造成的脂肪组织和形态上的改变(图1c)。日粮中添加CA逆转了120天饮食诱导的体重增加(图1d)。当肥胖的小鼠日粮更换为含有CA的粮食(F-FA),小鼠的30天内体重就恢复到正常水平,主要是WAT的减少(图1e)。除了阻止和逆转饮食诱导的肥胖,CA同样提高了高脂饮食小鼠的糖耐受。在一项独立的试验中,小鼠饲喂高脂饮食中添加人工FXR-α激动剂GW4064,并没有观察到抗饮食诱导肥胖的结果(图1f)。
日粮中添加CA同样使小鼠体脂降低,主要是WAT的降低。随着体脂的降低葡萄糖的耐受性升高。饲喂CA对于能量稳态与BA池大小及血清中BA水平以及BA组分的变化是一致的(图1g)。胆酸CA、牛磺胆酸(TCA)、脱氧胆酸(DCA)以及牛磺酸脱氧胆酸(TDCA)均显著升高。这些变化很可能会影响不同的BA信号通路。这些结果显示CA饮食阻止和逆转脂肪沉积以及相关的新陈代谢结果并不仅仅依赖于FXR-α,还存在其他的作用机制。
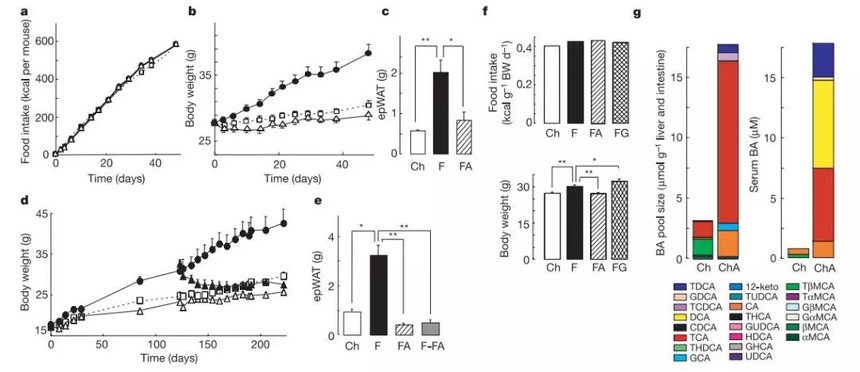
图1 CA降低高脂饮食小鼠的脂肪
a,b,47天里累积摄食(a)和体重(b)的变化;正方形:粗饲(Ch);圆圈:高脂饮食(F);三角形:高脂饮食加CA(FA)。c,附睾白色脂肪(epWAT)的比较。d,小鼠体重的变化。120天后高脂饮食小鼠一半转为饲喂FA饮食(黑色三角)。e,比较epWAT重量。F-FA组为更换粮食组。f,1个月后小鼠食物摄入以及体重(BW),GW4064为人工合成FXR-α激动剂(FG,HF加GW4064)。g,21天不同饮食下小鼠胆汁酸池及血清中胆汁酸组分。Glyco(糖G),Hyo(猪H),Urso(熊U),Muri(鼠M)。ChA,粗饲添加胆酸CA。
2、胆汁酸促进脂肪燃烧供能
相较于高脂饮食以及正常饮食小鼠,在含有CA的高脂饮食小鼠中,使用间接量热法检测到更高的CO2产出以及O2的消耗(图2a),表明活跃的能量合成代谢。饲喂CA降低了高脂饮食诱导的呼吸商(RQ),证明CA增加了脂肪的氧化。为了检验脂肪燃烧供能增加,我们实施了一项详尽的关键代谢组织的组织学分析。在WAT及BAT中高脂饮食会引起脂肪组织细胞过度增大,添加CA的高脂饮食则没有发现这一现象。电子显微镜分析BAT发现,与高脂饮食相比,添加CA增加了线粒体中片状脊的数量,说明BAT在CA诱导的能量消耗过程中发挥关键作用(图2b)。
我们使用芯片试验比较了来自饲喂高脂饮食以及添加CA或者鹅脱氧胆酸(CDCA)后高脂饮食小鼠的肝脏及BAT基因表达图示。主要的变化是肝脏基因的表达与胆固醇以及BA合成,但没有表现出体内能量稳态(数据未显示)。在BAT中,参与控制能量代谢的若干基因被BAs上调表达。我们主要关注受到影响最大的D2基因。D2转化未活化的甲状腺素(T4)为活化的3,5,3’-3碘化甲状腺氨酸(T3),并且是表达D2的细胞中的甲状腺激素受体饱和状态关键的决定因素。D2在体内能量稳态的不可或缺的作用已经在小鼠中得到验证,BAT适应性产热就是依赖于该酶。
我们采取反转录定量试验验证了BAs处理的D2,测定了参与体内能量稳态的基因的mRNA以及肝脏、肌肉及BAT中的BA信号。在能量消耗中的关键基因如PGC1α、PGC-1β、UCP-1、UCP-3、ACO、mCPT-I以及D2,在饲喂BA后的BAT中均上调表达(图2c)。在肝脏和肌肉中并没有发现相似的结果。在任何情况下在BAT中FXR-α以及SHP的表达都没有检测到,但是我们确认了肝脏中BAs诱导了SHP(图2c)。FGFR-4,另一个参与到BA信号中的基因,仅在肝脏中检测到大量表达。另外,使用GW4064处理并没有诱导像CA处理那样的产热基因的应答(数据未显示)。这些结果确认BAT是BAs在小鼠中新陈代谢结果的主要靶标,BAs在体内能量稳态的增益效果不仅仅依赖于FXR-α。
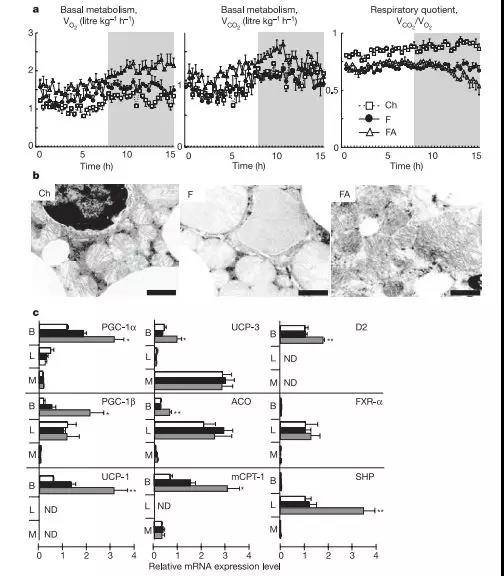
图2 CA提高能量代谢水平
a,不同饮食下4个月小鼠(n = 3,26周龄)O2消耗,CO2产生以及RQ(呼吸商)。适应时间2小时。O2消耗以(体重)0.75比标准化。阴影区域指示黑暗时间阶段。方形,粗饲(Ch);环形,高脂饮食(F);三角形,高脂饮食加CA(FA)。b,透射电镜肩胛区棕色脂肪BAT分析。比例尺1 μM。C,mRNA相对表达水平:PGC-1a、PGC-1b、UCP-1、UCP-3、ACO、mCPT-I、D2、FXR-a以及SHP,BAT(肩胛区棕色脂肪B),liver(肝脏L),muscle(肌肉M),ND,未检出(not detectable)。白框,粗饲Ch;黑框,高脂饮食F;灰框,高脂饮食补充胆酸FA。
3、胆汁酸控体重依赖于D2基因
在棕色脂肪中,检测发现高脂饮食下补充胆酸能够显著提高D2基因的表达。为验证D2在胆汁酸发挥作用的过程中的功能,我们在小鼠中敲除了该基因。结果显示,在D2缺失的情况下,饲喂高脂饮食并添加CA的小鼠抗肥胖的表型消失,结果见图3。D2突变小鼠中,高脂饮食补充胆酸CA后,附睾白色脂肪量及棕色脂肪量与对照组相比差异不显著(图3b),小鼠的体重也没有得到控制,与高脂饮食下的小鼠表现一致(图3a)。电镜检测小鼠棕色脂肪细胞,高脂饮食补充胆酸CA的D2突变小鼠并没有表现出抑制脂滴堆积,即CA促进脂肪燃烧的效果消失(图3c)。
在小鼠和人类D2基因的启动子上存在一个功能性cAMP应答元件(CRE)。TGR5是唯一已知的通过制造cAMP以及后续PKA信号通路的激活来应答胆汁酸的G蛋白受体。试验证实胆汁酸诱导cAMP的产生需要通过TGR5(图3d)。随着胆汁酸升高,BAs-TGR5互作及PKA信号增强(图3e)。TGR5以及D2均在小鼠大脑及BAT中共同高表达(图3f)。胆酸能够明显升高BAT中cAMP的水平(图3g)。
以上结果均表明胆汁酸作用于小鼠棕色脂肪BAT主要是通过G蛋白偶联受体如TGR5以及激活PKA信号通路有关。
4、胆汁酸BA-cAMP-D2-T3信号通路调控能量代谢
为验证胆汁酸BAs确实是通过TGR5来对cAMP及D2进行调控,我们选择了特异性的TGR5激动剂benzyl 2-keto-6-methyl-4-(2-thienyl)-1,2,3,4-tetrahydropyrimidine-5-carboxylate(图4f)。试验发现牛磺胆酸TCA对TGR5的激活作用要更强于该TGR5激动剂(图4f)。此外TGR5激动剂增强了HSMM细胞中D2的活性,说明胆汁酸对D2的作用可能是通过TGR5(图4g)。
最后我们研究了胆汁酸处理的人类肌肉细胞HSMM的耗氧情况及胞外酸化率。耗氧检测是一种研究线粒体氧化反应的方法,细胞外酸化率则是检测糖酵解、乳酸生产以及厌氧代谢的方法。牛磺胆酸TCA促进线粒体氧化反应的作用与T3一致(图4h)。暗示胆汁酸能够诱导D2,促进胎牛血清中的T4转化为T3。另外,在T3和牛磺胆酸TCA处理72小时后,HSMM细胞胞外酸化度均显著升高,说明耗氧作用导致了酸化增强。
综上结果说明,在小鼠棕色脂肪BAT以及人类肌肉细胞HSMM中,胆汁酸提高D2 mRNA表达、D2活性以及能量代谢是通过TGR5-cAMP介导的信号通路来完成的。在肝门静脉提取胆汁酸是非常高效的(70-90%)。断食阶段血清中胆汁酸BA往往低于5 μM,而进食后能够升高到15 μM。这与我们的体外试验中提高cAMP及D2水平的所需胆汁酸的浓度相一致。昼夜血清中胆汁酸水平变化因此可以作为摄食的指标,同时也是饮食诱导的能量代谢的关键因子。

图3 D2下的胆汁酸信号
a,50天后D2野生型小鼠和纯合突变小鼠的体重变化。黑框,野生型,高脂饮食(F);白框,野生型,高脂饮食添加胆酸(FA);黑圈,D2突变鼠,F饮食;白圈,D2突变鼠,FA饮食。b,epWAT以及BAT重量的比较。c,四氯化锇染色后BAT的电子显微镜分析。标尺,5 μM。d,转染pCRE-Luc以及TGR5表达载体到CHO细胞中CRE报告试验。浓度:100 μM BA,5 μM福司柯林(Fo)。C代表对照组。白格,载体;黑格,pTGR5。e,CER报告载体分析,转染CHO细胞使用pCRE-Luc和TGR5表达载体,不同BA浓度(1.8、5.5、17 μM)下。f,TGR5(黑框)和D2(白框)在小鼠不同组织中的表达。ND,无信号。g,小鼠7天饮食后BAT中cAMP水平。Ch,粗饲;ChA,粗饲加胆酸CA。误差线显示标准误s.e.m。
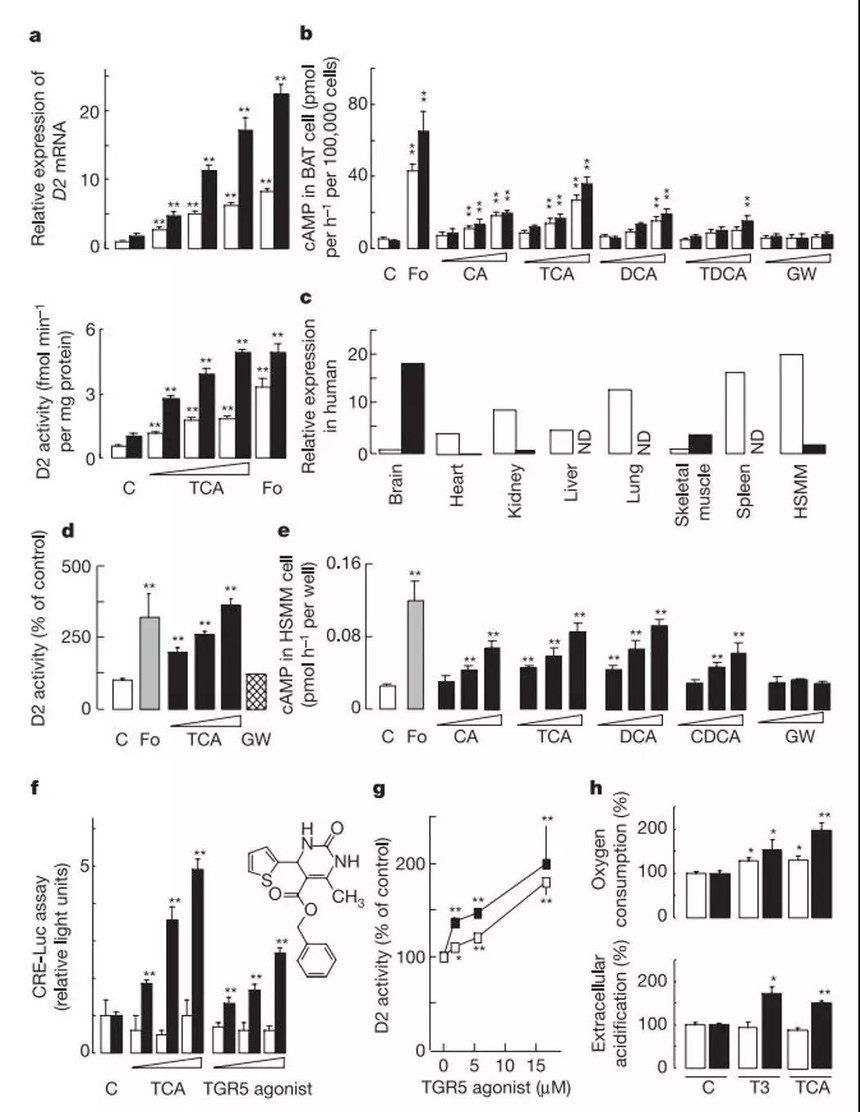
图4 BAs体外试验结果
a,饲喂不同粮食14天后小鼠BAT细胞中D2的表达(上半截)以及D2的活性(下半截)。白框,粗饲Ch;黑框,高脂饮食HF。细胞用TCA或者福司柯林Fo处理。b,BAT细胞中Bas诱导cAMP。GW,GW4064,分别使用浓度1.1、3.3以及10 μM。白框,粗饲Ch;黑框,高脂饮食HF。c,人类组织中TGR5(白框)以及D2(黑框)的表达。ND,无信号。d,HSMM中TCA(1.3、4、12 μM),GW4064(3 μM)以及福司柯林(10μM)诱导的D2活性。e,HSMM中BAs诱导的cAMP活性。f,CRE报告试验(方法同图3d)。激活剂使用浓度1、3.2、10 μM。白框,载体;黑框,pTGR5。G,人工TGR5激活剂(1、5、15 μM)在HSMM中诱导D2活性。白框,不含IBMX;黑框,添加1 mM IBMX。H,HSMM在5 μM TCA及50 nM T3处理下的耗氧(上半截)和胞外酸化率(下半截)。白框,48小时;黑框72小时。误差线显示标准误s.e.m。
参考文献:Watanabe M , Houten S M , Mataki C , et al. Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation[J]. Nature (London)
推荐
-

-

QQ空间
-

新浪微博
-

人人网
-

豆瓣

